
Fluoite bicolore - La Cabana - Coll et photo CL. François.
Georges CALAS
Laboratoire de Minéralogie -- Cristallographie
Universités de Paris 6 et 7 et Institut de Physique du Globe de
Paris, UMR CNRS 7590
4 place Jussieu 75252 Paris Cedex 05
" La
chaux fluatée est, parmi toutes les substances pierreuses, celle
qui s'est prêté davantage aux effets variés de l'action
colorante des oxydes métallique. Aussi, l'illusion que tend à
produire la ressemblance entre les teintes qui ornent ces différents
cristaux avec celle des pierres appelées gemmes, a-t-elle suggéré
les noms de faux rubis, faut saphir, fausse émeraude etc., que
les anciens minéralogistes lui avaient donnés suivant la
diversité de ses teintes. "
Haüy, Traité de Minéralogie (1822)
La fluorine CaF2, ou spath fluor, est le fluorure naturel le plus important, présente notamment dans de nombreux filons associés souvent aux roches de composition granitique ainsi que dans de nombreux gisements sédimentaires. La fluorine se présente généralement avec des formes cristallines très bien exprimées. Ce minéral est incolore à l'état pur, car il n'absorbe pas les radiations visibles (le spectre visible est approximativement compris entre 400 nm et 750 nm), étant remarquablement transparent depuis l'ultraviolet (125 nm, c'est-à-dire au-delà de la limite de transparence de l'air) jusqu'à l'infrarouge moyen (10 microns), d'où son utilisation fréquente comme matériau optique. L'excellente qualité optique de la plupart des échantillons naturels de fluorine permet d'observer une grande diversité de coloration, parfois associée à des propriétés de luminescence sous l'excitation de rayons ultraviolets ou de rayons X, ainsi que lors du chauffage d'un échantillon (thermoluminescence). La grande sensibilité des fluorures aux rayonnements liés aux éléments radioactifs va favoriser la formation de couleurs très variées, en relation avec la présence de centres colorés piégés sur différentes impuretés présentes dans le réseau cristallin de la fluorine.
L'ORIGINE DE LA COULEUR DES FLUORINES : UNE LONGUE
HISTOIRE
Comme les fluorines naturelles montrent une grande variété de couleurs, dont une propriété remarquable est d'être facilement détruites par chauffage ou même par simple action de la lumière du jour, l'origine de la coloration des fluorines a fait l'objet depuis très longtemps de nombreuses discussions. Les théories les plus variées ont ainsi été avancées : présence de chromophores organiques, d'impuretés variées, de colloïdes métalliques et de centres colorés, associés ou non à des impuretés. La théorie " organique " est très ancienne car l'analyse chimique des fluorines naturelles montre très souvent la présence de matières organiques. La décoloration des fluorines naturelles à haute température, déjà mise en évidence par De Saussure, a été ainsi expliquée par une décomposition de ces matières organiques. Celles-ci sont en fait concentrées dans les inclusions fluides et ne sont pas localisées au sein du réseau cristallin, et l'étude des spectres d'absorption optique des fluorines naturelles a permis d'écarter définitivement cette théorie. Berthelot, dès 1906, avait montré que les matières radioactives permettaient de colorer de façon efficace les fluorines. Cependant, par rapport à d'autres halogénures alcalins naturels, dans lesquels les défauts liés à une irradiation ont été compris dès les années 1960, les défauts créés par irradiation dans les fluorines naturelles sont toujours associées à des impuretés, ce qui en complique la détermination. C'est en fait la comparaison avec des cristaux synthétiques qui a permis de déterminer de façon non ambiguë l'origine de la coloration des cristaux naturels en montrant l'influence de certaines terres rares et d'autres impuretés dans l'origine de la coloration. Cependant certains mécanismes de coloration, comme ceux qui sont à l'origine des fluorines naturelles jaunes, n'ont pu être reproduites dans les cristaux synthétiques.
LA STRUCTURE DE LA FLUORINE
Exemple classique d'un réseau cubique faces centrées, la fluorine a été un des premiers minéraux dont la structure a été déterminée par William H. Bragg dès 1914. Cette structure peut-être décrite comme un empilement cubique faces centrées d'ions Ca2+ qui délimitent des cavités tétraédriques occupées par les ions F- (Figure 1).
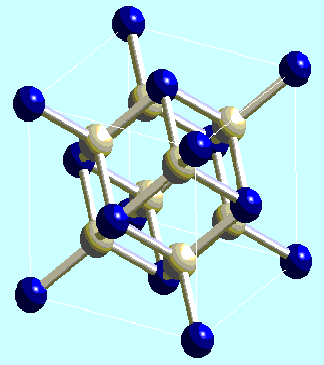
Fig. 1- Structure de la fluorine. Les sommets de la maille représentent
les atomes de calcium et les atomes de fluor se trouvent dans les cavités
tétraédriques de cet empilement cubique faces centrées.
-- La substitution des terres rares dans le réseau de la fluorine.
Le calcium se trouve ainsi entouré de 8 voisins fluor qui forment
une cavité cubique de grande taille, susceptible d'accommoder des
impuretés comme les terres rares. Les ions de terres rares, généralement
trivalents, ne pourront se substituer au calcium le réseau de la
fluorine que s'il existe une compensation de charge qui assure la conservation
de la neutralité électrique du cristal. Il existe de nombreuses
possibilités pour assurer une compensation de charge dans un réseau
comme celui de la fluorine. Si la compensation de charge est lointaine,
la symétrie initiale du site occupé par le calcium est conservée.
On peut ainsi penser que ce sont les premiers voisins contribuent à
l'essentiel du champ cristallin vu par le cation. En revanche, une compensation
de charge à proximité de la terre rare va inévitablement
abaisser la symétrie locale. Cette compensation de charge peut
se faire dans le site cationique le plus proche (par exemple, substitution
d'un ion calcium par un ion sodium selon la réaction de substitution
couplée suivante : 2Ca2+=Na+ + TR3+). Une compensation de charge
peut également être assurée au niveau de l'environnement
anionique de la terre rare, soit par la présence d'une lacune de
fluor soit par le remplacement d'une partie des ions fluor par les ions
oxygène. Il est intéressant de constater que, pour une terre
rare donnée, la symétrie des sites observées dans
les fluorines naturelles va être différentes de celle qui
est généralement déterminée dans les cristaux
synthétiques, et que de plus elles varie en fonction des gisements.
-- Un exemple
simple de centre coloré : le centre F. Lorsque l'on irradie un
cristal d'halogénure alcalin avec un rayonnement de haute énergie
(par exemple, rayons X ou gamma, faisceau d'électrons...), on observe
rapidement une coloration de l'échantillon à l'endroit où
il a été irradié. Dans le cas du chlorure de sodium,
le sel gemme, une coloration jaune apparaît ainsi. Cette coloration
est réversible, car si on chauffe le cristal, celui-ci se décolore
en émettant de la lumière (thermoluminescence). L'origine
de cette coloration se trouve dans la formation d'un centre F, qui représente
une lacune de chlore qui a piégé un électron lors
de l'irradiation, électron arraché à d'autres défauts
ou à une impureté formant ainsi un trou positif. Cet électron
célibataire possède différents niveaux d'énergie
qui vont permettre des transitions à l'origine d'une absorption
spécifique de la lumière. Lors du chauffage, l'électron
va quitter ce piège instable pour être piégé
sur un des trous positifs créés lors de l'irradiation.
Dans le cas de la fluorine, la présence de nombreuses impuretés
comme les terres rares mentionnées plus haut va amener la formation
de centres plus complexes en même temps qu'elle va expliquer l'origine
de la diversité des couleurs des cristaux naturels. Trois types
de coloration différents peuvent être distingués :
défauts ponctuels associés à une terre rare ou à
d'autres impuretés, électrons piégés sur une
terre rare et colloïdes de calcium. Il est cependant plus simple,
en se souvenant de cette diversité d'origine, d'examiner successivement
les principales colorations observées dans les fluorines naturelles.
L'ORIGINE DES DIVERSES COULEURS OBSERVEES DANS LES
FLUORINES NATURELLES
--
la couleur mauve ou violette. C'est probablement la couleur la plus fréquemment
rencontrée dans la plupart des gisements de fluorines. Elle est
liée à la présence d'une bande d'absorption intense
et large située au milieu du spectre visible, aux alentours de
570 nm (Figure 2). Des bandes d'absorption de plus faible intensité
se situent également dans la partie ultraviolette du spectre, et
n'influent donc pas sur le processus de coloration ; elles sont liées
à la présence d'autres centres colorés (voir plus
bas). Cette bande d'absorption intense est en fait lié à
la présence de colloïdes de calcium de taille comprise entre
30 et 40 nm, finement dispersés à l'intérieur du
réseau de la fluorine. La variabilité des couleurs observées,
depuis le bleu intense jusqu'au mauve foncé, est à relier
à des colloïdes de taille différente, la position du
maximum d'absorption se déplaçant vers des longueurs d'onde
plus grandes lorsque la taille des colloïdes augmente. La relation
avec des inclusions radioactives est souvent mise en évidence par
une distribution irrégulière de la couleur, souvent décrite
comme indiquant la présence de halos pléochroïques.
C'est notamment le cas de minéraux contenant de l'uranium qui va
amener une irradiation du cristal par des rayons alpha sur une profondeur
de quelques microns. La formation de colloïdes de calcium indique
une désorganisation importante du réseau cristallin : lorsque
leur concentration est importante, comme dans le cas de la variété
anthozonite que l'on rencontre fréquemment au voisinage des gisements
d'uranium, il se dégage au broyage du minéral une odeur
de fluor caractéristique.
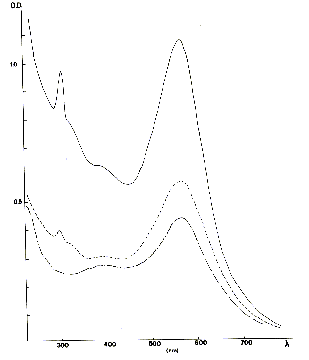
Fig. 2 - Spectre d'absorption optique de fluorines violettes et mauves.
De haut en bas: Foisches et Fontsantes (Var) et Djebel Kohol (Tunisie).
L'axe vertical représente l'absorbance (densité optique:
D.O.) de l'échantillon. En abscisse, la longueur d'onde en nanomètres.
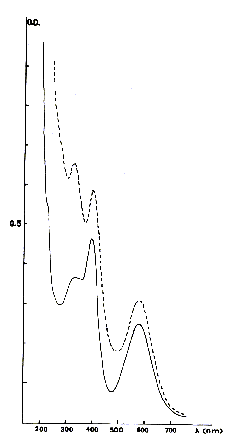
Fig. 3 - Spectre d'absorption optique de fluorines bleues. En tirets,
fluorine de Ponteaumur (Puits de Dôme), en traits pleins, fluorine
de la mine Moritz (Vosges).
-- la couleur bleue. Lorsque la couleur est très intense, comme
dans le cas des fluorines de type Blue John utilisées en décoration,
l'origine de la coloration est similaire à celle des fluorines
mauves décrite plus haut. Il existe cependant une autre coloration
fréquemment rencontrée, donnant des cristaux de teinte beaucoup
plus claire et qui est d'origine différente. Dans ce cas, le spectre
optique est très différent du précédent. Sa
structure complexe montre la présence de plusieurs bandes d'absorption
situées dans le spectre visible ou dans le proche ultraviolet (Figure
3). Cette couleur est facilement reproduite par irradiation des cristaux
avec des rayons X. Son origine réside dans l'association entre
un centre F, tel qu'il était décrit plus haut, et un atome
d'yttrium en substitution du calcium, donnant à ce centre complexe
une symétrie (111). La présence fréquente de zonations
montre que l'irradiation responsable de sa formation ne peut venir de
l'extérieur du cristal. La faible épaisseur de ces couches
colorées, développées selon des faces de croissance,
indiquerait une irradiation liée à des émetteurs
a. Les rayons a provenant du thorium pénètrent ainsi de
14 mm dans les cristaux de fluorine, et le piégeage de telles impuretés
sur un front de croissance permet ainsi de rendre compte de ces zonations.
Une fluorescence bleue à violette est parfois observée dans
certaines fluorines comme celles du Derbyshire leur donnant une teinte
particulière, puisque les échantillons peuvent être
verts lorsqu'ils sont vus par transparence mais émettent en même
temps une couleur bleue à violette. Cette propriété
est liée à la présence d'europium divalent, substituant
le calcium, un degré d'oxydation réduit de cette terre rare,
qui traduit des conditions de formation particulièrement réductrices
lors de la croissance de ces fluorines.
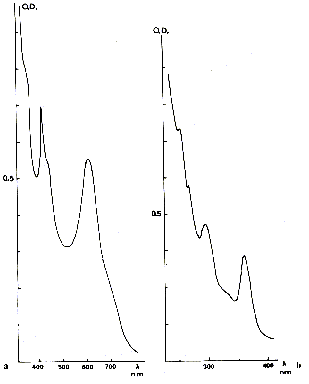
Fig. 4 - Spectre d'absorption optique d'une fluorine verte de Weardale
(Cumberland, Angleterre)
-- la couleur verte. Il s'agit une coloration très fréquemment
rencontrée dans de nombreuses fluorines hydrothermales. Le spectre
optique est plus complexe que celui qui est rencontré dans le cas
des autres fluorines colorées, avec de nombreuses bandes d'absorption
situées dans le domaine visible et proche UV. Son origine est liée
à la présence d'une terre rare divalente, le samarium. Comme
dans le cas de l'europium vu plus haut, ce degré d'oxydation est
inhabituel. Dans ce cas cependant, il s'agit pas d'un effet lié
à une formation en conditions particulièrement réductrices,
mais d'une conséquence d'une irradiation naturelle. Lorsque le
samarium est trivalent, ce qui correspond à son degré d'oxydation
habituel, le cristal contenant cette terre rare est incolore. L'action
d'une irradiation le fait passer à ce degré d'oxydation
instable, qui s'accompagne d'une coloration verte caractéristique.
Cette coloration peut être détruite par chauffage du cristal,
le samarium repassant à nouveau à l'état trivalent.
-- la couleur rose. Cette couleur est caractéristique des fluorines
trouvées dans les filons alpins, gisements dans lesquels les cristaux
sont habituellement de faciès octaédrique. Le spectre optique
montre essentiellement la présence d'une bande d'absorption large
centrée vers 485 nm, avec des transitions de faible intensité,
situées dans le proche ultraviolet, permettant donc aux seules
radiations rouges d'être transmises par le cristal (Figure 4). Le
centre à l'origine de cette coloration est composé d'un
ion Y3+ associé à un ion moléculaire O23-, formant
ainsi un groupement (YO2). Cet ion moléculaire provient du piégeage
d'un trou positif lors de l'irradiation deux ions O2- voisins présents
en impureté dans le cristal. Cet ion moléculaire instable
est détruit par chauffage, la capture d'un électron permettant
une dissociation deux ions O2-. Comme dans le cas des colorations vues
plus haut, le centre coloré responsable de la coloration rose peut
être reproduit par irradiation de cristaux de fluorines qui contiennent
de l'oxygène en impureté.
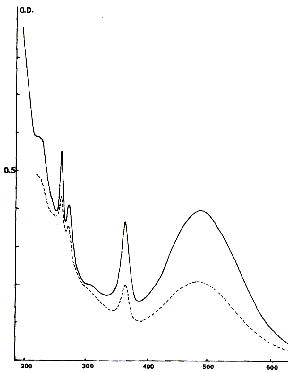
Fig. 5 - Spectre d'absorption optique de fluorines roses des Alpes
(Les Périades et Chamonix)
-- la couleur jaune. Autre coloration caractéristique des fluorines, notamment dans les gisements de basse température, la couleur jaune est liée à un spectre d'absorption très différent des précédents. En dehors de deux faibles bandes d'absorption situées dans le proche UV, le spectre montre surtout la présence d'une bande d'absorption unique, centrée dans la zone violette du spectre vers 430 nm comme on le voit dans les fameuses fluorines de Valzergues (Aveyron), mais aussi dans de nombreux autres gisements comme ceux de l'Illinois (Figure 5). La présence d'une structure complexe superposée, composée de huit raies de faible intensité et liée aux vibrations de l'ion moléculaire à l'origine de cette coloration indique que le centre coloré responsable est constitué d'un ion moléculaire O3- qui se substitue à deux ions fluor voisins. La couleur jaune est relativement stable thermiquement, et est détruite en deux jours à 320°C (Figure 6), à comparer à une stabilité de quelques minutes pour la couleur bleue à cette température. Contrairement à la plupart des autres colorations de la fluorine, la couleur jaune ne peut être reproduite expérimentalement. Le processus de décoloration thermique des fluorines jaunes est donc irréversible.
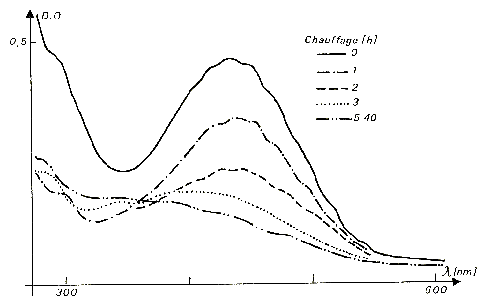
Fig. 6 - Spectre d'absorption optique d'une fluorine jaune, montrant
l'influence d'un recuit à 320°C (temps de recuit en heures).
LA STABILITE DE LA COULEUR DES FLUORINES
Lorsque les cristaux de fluorines sont chauffés, et parfois simplement exposés à la lumière du jour, ils se décolorent de façon généralement réversible. Les couleurs les plus stables thermiquement sont les couleurs les plus intenses, mauve, violet ou bleu foncé, en relation avec la présence de colloïdes de calcium. Les moins stables sont les fluorines de couleur bleu clair et leur présence ne peut être expliquée que par une irradiation récente. Les autres colorations mentionnées plus haut sont stables à température ambiante sur des durées géologiques : il s'agit donc de colorations primaires, pouvant avoir été créées pendant la croissance du cristal. En étudiant la cinétique de décoloration des fluorines, il est possible de les utiliser comme indicateurs de la température maximale au-delà de laquelle le système géologique dans lequel a été échantillonné le cristal n'a pu être porté sans que les cristaux soient décolorés. La confrontation avec les valeurs de température de formation des cristaux, données par les inclusions fluides, permet de disposer de plusieurs paramètres concernant l'histoire thermique du filon. Dans le cas des fluorines jaunes de Valzergues (Aveyron), formées à 130-140°C, on a pu ainsi montrer que le filon n'a pas pu être porté au-delà de 220°C, température au-dessus de laquelle la coloration est détruite de façon irréversible. La vitesse minimum de refroidissement du filon a été de 10-2 °C par an. On peut noter que dans ces conditions, la coloration bleue observée dans de nombreux échantillons de ce gisement serait ainsi détruite en quelques jours à la température de formation des fluorines, ce qui montre bien leur origine secondaire, liée à une irradiation plus récente. Les dégâts d'irradiation dans les minéraux permettent ainsi de donner des indications précieuses sur l'histoire d'un échantillon.